1.مقدمة
تجري التحاليل الكيميائية لمياه الشرب لمعرفة خصائص المياه ومكوناتها الكيميائية , ومعرفة مدي احتوائها علي ملوثات كيميائية أو عناصر كيميائية ضارة وميد مطابقتها للمواصفات القياسية الخاصة بجودة مياه الشرب. ولكل اختبار مدلول معين علي جودة المياه الخام وجودة المياه المعالجة المنقاة
2.التحاليل الكيميائية ومدلولاتها في مياه الشرب
أ-المواد الصلبة Solids
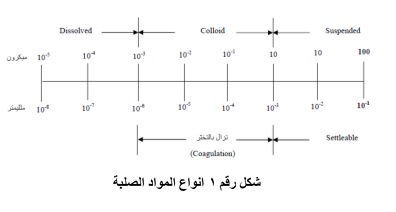
تختلف تركيزات كمية المواد الصلبة الكلية فى مياه الشرب. ومحتوى المياه من المواد الصلبة يقاس بتبخير لتر واحد من المياه عند ١٠٣ م – ١٠٥ م، ثم وزن كتلة المواد الصلبة المتبقية وتصنف المواد الصلبة كما هو موضح فى الشكل التالي شكل رقم 1 الي:
1 – مواد عالقة Suspended وهى المواد التى لا يقل نصف قطرها عن ١ ميكرون على الأقل.
2-مواد قابلة للترسيب Settleable وهى التى تترسب فى قاع مخروط إمهوف Imhoff Cone فى فترة زمنية مقدارها ساعة، وهى مقياس لما يمكن إزالته بالترسيب.
3- مواد ذائبة أو قابلة للترشيح Filterable or Dissolved وهذه المواد إما أن تكون غروية (نصف قطر حبيباتها يتراوح بين ١ مللي ميكرون إلى ١ ميكرون) أو مواد ذائبة كليًا. وكلما زادت كمية الأملاح الذائبة، كلما ساءت نوعية المياه سواء للاستخدام الآدمي أو الصناعى، لذلك فإن تركيزًا قدره ٥٠٠ ملليجرام/ لتر يعتبر مستوى معقولا فى مياه الشرب. ويجب ألا تزيد هذه النسبة عن ١٠٠ مللجرام/ لتر، وتحسب هذه الكمية بتبخير لتر من الماء بعد ترشيحه، ووزن الراسب المتكون. ولا يمكن إزالة الغرويات بالترسيب، ولكن تفصل بالأكسدة البيولوجية أو الترويب.
ويمكن تصنيف أنواع المواد الصلبة السابق ذكرها على أساس وزن ما يتطاير منها بالتسخين عند درجة حرارة ٦٠٠ مئوية ، حيث يتم أكسدة الجزء العضوي وتطايره مخلفا الجزء غير العضوي ، ولا تتأثر معظم المواد غير العضوية بالتسخين عند درجة ٦٠٠ مئوية سوى كربونات الماغنسيوم التى تتحول عند درجة ٣٥٠ مئوية إلى أكسيد الماغنسيوم، وثاني أكسيد الكربون.
ب- الحديد والمنجنيز Iron and Manganese
يوجد المنجنيز والحديد عادة بكميات ملحوظة فى المياه الجوفية نتيجة اختراق المياه لطبقات الارض وذوبان الحديد والمنجنيز بها وتتراوح نسبة المنجنيز في المياه الجوفية ما بين (0.1 الي 1.0 مجم/لتر) وغالبا ما تكون على هيئة بيكربونات او كبريتات أما الحديد فيتراوح نسبته في المياه الجوفية من (0.01 الي 0.3 مجم/لتر) ويتأكسد الحديد والمنجنيز الذائب في الماء عند تعرضه للهواء الجوى.
طرق التخلص من الحديد والمنجنيز
١. طريقة الأكسدة بالتهوية: يتم عمل تهويه وينتج عن ذلك عوالق صغيرة جدا من الرواسب يمكن ازالتها بعد ذلك خلال عمليه الترسيب أو الترشيح أو أكسده الحديد والمنجنيز باضافة ماده مؤكسدة مثل الكلور أو البرمنجنات في حوض تلامس الى مواد غير ذائبة والتخلص منها.
٢. طريقة الأكسدة ببرمنجنات البوتاسيوم مع استخدام زيوليت المنجنيز أو رمال المنجنيز الخضراء Manganese Green Sand
٣. طريقة البولى فوسفات: تستخدم هذه الطريقة عندما يكون الحد الأقصى للمنجنيز 3,0 والحديد 1,0 مللى جرام/ لتر.
دلائل الاختبار
عنصر الحديد:
غير ضار، ولكن وجوده بتركيز عال يجعل للمياه طعمًا غير مستساغ، كما أن المياه المحتوية عليه عندما تتعرض للأكسجين فإن الحديد يترسب ويؤدي إلى ظهور بقع فى الغسيل والأحواض. والحد الأقصى المسموح به فى مياه الشرب فى التشريعات المصرية 0.3 مجم/ لتر.
عنصر المنجنيز:
وجود كميات ضئيلة منه يؤدي إلى مشاكل كثيرة، والكميات الكبيرة منه سامة، ومصدره غالبًا التلوث الصناعي، والحد الأقصى المسموح به فى مياه الشرب فى التشريعات المصرية 4,0 مجم/ لتر.
ج- الرصاص والنحاس Lead and Copper
أسباب ومصدر التلوث بالرصاص/ النحاس
نادرًا ما يوجد في الطبيعة في مصدر المياه ولكن قد يوجد نتيجة التلوث الصناعى أو بسبب اللحامات الموجودة بالمواسير النحاس والحديد والبرونز كما قد تكون نتيجة المواسير المصنوعة من الرصاص مثل المواسير الفرعية الموصلة للمنازل أو في بعض خطوط شبكة المياه، والعنصرين سامين بالتراكم، وتتسبب المياه المحتوية عليهما فى الإصابة بالإمساك/ الاضطرابات المعوية/ الأنيميا/ الشلل التدريجي للعضلات وأضرار أخري.
دلائل الاختبار
عنصر الرصاص:
وهو عنصر سام بالتراكم، وتتسبب المياه المحتوية عليه فى الإصابة بالإمساك – الاضطرابات المعوية – الأنيميا – الشلل التدريجي للعضلات، وهو يستخدم فى الصناعة، ومواسير الرصاص، والحد الأقصى المسموح به فى مياه الشرب فى التشريعات المصرية ٠1,٠ مجم/ لتر.
عنصر النحاس:
لا يسبب تسممًا بالتراكم، والتسمم به يمكن تجنبه بالاعتماد على التذوق، حيث يمكن تمييزه عندما تصل تركيزاته إلى 1-2 مجم/لتر. ولا يحدث تسمم إلا بتركيزات أعلى من ذلك بكثير. ومصدر وجود النحاس بتركيزات عالية ناشئ عن التلوث الزراعي والصرف الصحي. والحد الأقصى المسموح به فى مياه الشرب فى التشريعات المصرية ٢ مجم/ لتر.
د-الأكسجين الذائب Dissolved Oxygen
الأكسجين الذائب من العوامل الهامة جدًا فى الأنظمة المائية، ومصدره الرئيسي هو الهواء المحيط، وعمليات التمثيل الضوئي للنباتات الخضراء.
ويمكن اعتبار الأكسجين المذاب معيارًا لتحديد نوعية المياه. فالمياه الملوثة بمواد عضوية يقل فيها الأكسجين المذاب. ووجود كمية مناسبة من الأكسجين فى الماء يعمل أيضًا على تنقية المياه ذاتيًا، ويجب ألا تقل هذه الكمية عن ٥ مجم/ لتر فى المياه الصالحة للشرب.
تعتمد نسبة الأكسجين الذائب في المياه الطبيعية على الخصائص الكيميائية والفيزيائية والبيولوجية للماء. وتحليل الأكسجين الذائب له أهمية في عملية التحكم بمعالجة تلوث المياه ومن الطرق المستخدمة لتقدير الأكسجين الذائب طريقة قينكلر(الأيودومترية) والطريقة الكهربائية باستخدام قطب غشائي . مياه الشرب يجب أن لا يقل تركيز الأكسجين الذائب عن 2 جزء في المليون ppm (هذا التركيز متغير من كتاب إلى آخر) . ارتفاع حرارة المياه يؤدي إلى نقص الأكسجين الضروري للبكتيريا الهوائية لتقوم بتفكيك المواد العضوية ويؤدي إلى زيادة النشاط البيولوجي للكائنات المائية وزيادة الطلب على الأكسجين .
ويتم إجراء اختبارات الأكسجين الذائب للمياه المعالجة بهدف الحد من حدوث تآكل للطلمبات وشبكات المياه وذلك حيث أن زيادة الأكسجين تساعد على تآكل الحديد.
تفسير النتائج
يمكن اعتبار الأكسجين المذاب معيارًا لتحديد نوعية المياه، فالمياه الملوثة بمواد عضوية يقل الأكسجين المذاب بها ( حيث يحدث له استنزاف نتيجة التحلل العضوي بفعل البكتيريا )، ووجود كمية مناسبة من الأكسجين في الماء تعمل على تنقية المياه ذاتيًا.
ر- الأس (الرقم) الأيدروجيني pH
يعتبر قياس الأس الهيدروجيني pH من أهم المعايير، وأكثرها استخدامًا فى التحقق من نوعية المياه، ويستخدم هذا الأس فى حسابات القلوية، وثاني أكسيد الكربون، والتوازنات الحامضية والقاعدية. ويتراوح الأس الأيدروجيني للمياه الطبيعية عادة بين ٩ ،٦ ، وتميل معظمها إلى القلوية لوجود البيكربونات والكربونات لبعض عناصر الإقلاء والإقلاء الأرضية.
دلائل الاختبار
ومستوى الأس الأيدروجينى فى مياه الشرب يجب ان يتراوح بين 5,6 و 5,8. ويادة الاس الهيدروجيني عن هذهالنسبة يدل علي ورود ملوثات زراعية أو مخلفات الصناعية في المياه مثل الأملاح غير العضوية والأحماض والقواعد والمواد العضوية والمواد العالقة والمواد المسببة للرغوة… ألخ تغير من الرقم الهيدروجينى للمياه.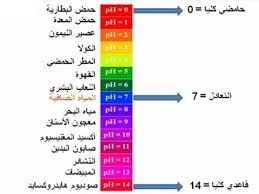
ز-التوصيلية الكهربية Electrical Conductivity
التوصيلية الكهربية، هو رقم للتعبير عن قابلية المحلول المائي لتوصيل التيار الكهربي، وهذه القدرة تعتمد على وجود الأملاح، وتركيزها، وتكافؤات أيوناتها. ويتراوح التوصيل الكهربي للمياه الصالحة للشرب من ٥٠ إلى ١٥٠٠ ميكروسيمنز/ سم.
قياس التوصيل الكهربي الذي يتفاوت نتيجة ذوبان بعض الأملاح المعدنية ويمكن استخدام قيم التوصيل الكهربي فى معرفة كمية المواد الذائبة، ومعامل التحويل يتراوح بين 0.55 إلى 0.9 وعند ضرب قيمة التوصيل الكهربي (ميكروسيمنز/ سم) فى هذا المعامل ينتج كمية المواد الذائبة (مجم/ لتر).
تحتوي المياه الطبيعية العذبة على تراكيز خفيفة من الأملاح المعدنية المتأينة وبالتالي فجميعها تشارك في التوصيلية الكهربائية، وتنتج التوصيلية العالية عن ارتفاع نسبة الملوحة بسبب الملوثات المعدنية. وتعرف التوصيلية الكهربائية بأنها قياس مدى قابلية نقل الماء للتيار الكهربائي بوحدة الميكروسيمنز / سم؛ إذ أنه كلما كان تركيز المواد الصلبة الذائبة في الماء أكبر كلما كان قابلية الماء لنقل التيار الكهربائي أكبر، وتعتمد قيمة التوصيل الكهربائي على تركيز الأيونات الموجودة في المياه، وهي قابلية 1.0 سم3 من الماء على توصيل التيار الكهربائي عند 25.0oم وتمثل مقلوب المقاومة النوعية للماء (مقلوب الاوم ohm وتسمى بالموز moh).

ل- القلوية Alkalinity
هي مقدرة المياه على معادلة الأحماض المضافة إليها أو هي مقياس لمدى قدرة الأيونات السالبة الموجودة بالمياه على معادلة الأيونات الموجبة المضافة.
وتحسب قلوية المياه بإضافة حمض الكبريتيك فى وجود دليلي الفينولفثالين والميثيل البرتقالي. وليست هناك أضرار من المياه المحتوية على قلوية حتى ٤٠٠ مجم/ لتر.
دلائل الاختبار
تعزى قلوية المياه لوجود هيدروكسيدات – كربونات – بيكربونات بعض عناصر الأقلاء، ويؤدى ارتفاع قلوية المياه إلى تزايد التكاثر البيولوجي.
م-العسر الكلي المياه Total Hardness
العسر هو عدم قدرة الماء على تكوين رغوة مع الصابون وتوجد الأملاح المسببة لعسر المياه بتركيزات متفاوتة تزيد عادة في المياه الجوفية حسب مكونات طبقات التربة التي تمر خلالها المياه .
يعرف العسر الكلي على أنه مجموع تركيز أيونات الكالسيوم والماغنسيوم بالعينة، معبرًا عنه بتركيز كربونات كالسيوم (مجم/ لتر) وينعكس فى عدم قدرة الماء على تكوين رغوة مع الصابون وتوجد الأملاح المسببة لعسر المياه بتركيزات متفاوتة تزيد عادة في المياه الجوفية حسب مكونات طبقات التربة التي تمر خلالها المياه ويسمح بمستوى من العسر الكلي فى حدود ١٠٠ مجم/ لتر، بحد أقصى ٥٠٠ مجم/ لتر من كربونات الكالسيوم
دلائل الاختبار
يعرف العسر الكلي على أنه مجموع تركيزي الكالسيوم والماغنسيوم، معبرًا عنه بتركيز كربونات كالسيوم(مجم/ لتر). ويُعزى العسر إلى وجود الكالسيوم، والماغنسيوم فى صورة بيكربونات، كلوريدات وكبريتات. ويمثل مجموعات العسر المؤقت (بيكربونات عناصر الأقلاء الأرضية)، والعسر الدائم (كلوريدات وكبريتات عناصر الأقلاء الأرضية) العسر الكلي. ويسمح بتركيز مقداره 4,0 مجم مكافئ لكل كيلوجرام من العسر للاستخدام الصناعي .
ن- العكارة Turbidity
العكارة هو تعبير مبسط لعتامة المياه الطبيعية Cloudiness”” وهي مدلول عن وجود بعض المواد العالقة في الماء , وتعتمد طريقة قياس العكارة على مقارنة كمية الضوء الذي يتشتت عند سقوطه على محلول معلق قياسى(فورمازين) بكمية الضوء المشتت عند استخدام العينة وكلما زادت العكارة ازداد التشتت , وتقدر بوحدات .(Nephelometric Turbidity Units) (NTU)
مسببات العكارة
من الممكن أن يكون سبب العكارة هو الفيتوبلانكتون ( الكائنات الهائمة النباتية) في المجاري المائية المفتوحة. كما تتسبب بعض النشاطات الإنسانية في تعكير المياه مثل البناء والتشييد والذي قد يؤدي إلى مستويات ترسيب عالية تدخل في المياه خلال العواصف الممطرة التي تزيد منسوب المياه ومن ثم تتعكر المياه. كما تتسبب المناطق الحضرية والمعرضة للتعرية إلى تعكير كميات كبيرة للمياه المجاورة لها، عن طريق مياه العواصف الملوثة القادمة من الطرقات والكباري وأماكن انتظار السيارات،حيث تنزلق هذه المياه في المجاري المائية. بعض الصناعات مثل التعدين ومناجم الفحم تسبب مستويات عالية جدا من العكارة نتيجة للصخور المفتتة التي تسقط في الماء.
يظن البعض أن كلما زادت مستويات العكارة في مياه الشرب، كلما زادت فرص الإصابة بأمراض الجهاز الهضمي، حيث تكون الجزيئات العالقة بمثابة الدرع لأي فيروسات وبكتيريا موجودة وفي الماء وتمنع الكلور من القضاء عليها. كما أن الأجسام المعلقة من الممكن أن تحمي البكتيريا من الأشعة فوق البنفسجية التي تطلق عليها لتعقيمه.
في المسطحات المائية مثل: البحيرات ،والأنهار، والخزانات المائية من الممكن أن تتسبب مستويات العكارة العالية في تقليل كمية الضوء التي تصل إلى الأعماق والقاع، مما يمنع نمو النباتات المائية ويؤثر بالتالي على الكائنات البحرية التي تتغذى على هذه النباتات مثل الأسماك والمحار. رصدت هذه الظاهرة فعلا في شرق الولايات المتحدة في منطقة خليج تشيزبيك.
على الجانب الأخر، تحتاج بعض الكائنات إلى مستويات عكارة عالية لتعيش ويظل النظام البيئي متوازنا، مثل مناطق نبات الأيكة الساحلية حيث تساهم العكارة العالية في حماية بعض الأسماك الصغيرة من الأسماك المفترسة. نموذج لهذه المناطق هي شرق أستراليا حيث يقع خليج موريتون والذي يلزم وجود مستوى عكارة يصل إلى 6 ليتم الحفاظ على النظام البيئي الموجود.
دلائل الاختبار
يتسبب وجود مواد عالقة فى المياه فى تعكيرها، وهذه المواد مثل الطمي، والمواد العضوية، وغير العضوية الدقيقة، والمواد العضوية الذائبة، والكائنات الميكروسكوبية. وصفاء الماء عنصر هام فى تحديد صلاحية نوعية المياه التى يستخدمها الإنسان. ولقد اقترحت منظمة الصحة العالمية أن العكارة يجب أن تكون أقل من ٥ ولا تزيد عن ٢٥ وحدة. ومستوى العكارة فى مياه الشرب يجب ألا يزيد عن وحدة واحدةNTU . طبقا للقرار المصرى رقم ٤٥٨ لسنة ٢٠٠٧
أحــمــد السـروي
إستشاري معالجة المياه وجودة المختبرات والبيئة
المراجع العلمية
- احمد السروي ,العمليات الاساسية لتنقية مياه الشرب , دار الكتب العلمية , 2012.
- احمد السيد خليل ,عملية تنقية الماء للاستخدام المنزلي , 2008.
- البرنامج التدريبي لمشغلي محطات تنقية مياه الشرب المستوى (ج) دليل المتدرب ,الجزء الثاني الاختبارات المعملية , مشروع دعم قطاع مياه الشرب والصرف الصحي , الوآالة الأمريكية للتنمية الدولية , 2012.
- البرنامج التدريبي لمحللي معامل تحاليل مياه الشرب المستوى (ج) دليل المتدرب ,الجزء الثاني الاختبارات المعملية , مشروع دعم قطاع مياه الشرب والصرف الصحي , الوآالة الأمريكية للتنمية الدولية , 2013.




