1.مقدمة
قد ترتفع أو تنخفض بعض العناصر أو المركبات في مياه الشرب الخام او اثناء المعالجة او بعد التنقية والمعالجة لاسباب قد ترتبط بوجود مكونات اخري في المياه او اصابة الماء بتغير او نلوث ما او نتيجة لتغير ظروف طبيعية ما , وهذا الارتفاع او الانخفاض في تلك المركبات او العناصر له اسباب كما ان له تاثير علي خصائص المياه ويعطي مدلولا معينا علي حدوث خلل ما في البيئة المائية أو في منظومة المعالجة .
وسوف نتناول بعض العناصر والمركبات التي قد تتواجد في الماء أو تتواجد اثناء او بعد التنقية والمعالجة ومدلولات إرتفاع أو إنخفاض نسبتها أو تركيزاتها وتاثير ذلك.
2.أسباب وجود وتأثير بعض العناصر في مياه الشرب
أ-الأكسجين الذائب Dissolved Oxygen
الأكسجين قليل الذوبان في الماء ويتغير معدل الذوبان طبقًا لمستوى الضغط الجوي عند درجة حرارة معينة، كما يتغير باختلاف درجات الحرارة ومن المهم معرفة الظروف الخاصة للمياه عند القياس حيث يقل الأكسجين المذاب في الصيف عنه في الشتاء ونهارًا عنه في الليل ويعبر عن كمية الأكسجين المذاب بالملليجرام في اللتر.
ويؤدى وجود الطحالب فى الماء إلى إنتاج الأكسجين نهارا فتزداد نسبة الأكسجين الذائب فى الماء .
الأكسجين الذائب من العوامل الهامة جدًا في الأنظمة المائية ومصدره الرئيسي هو الهواء المحيط وعمليات التمثيل الضوئي للنباتات الخضراء.
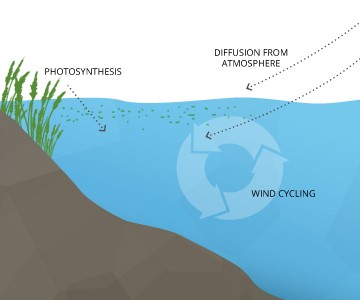
أسباب إرتفاع وإنخفاض الأكسجين الذائب في المياه وتأثير ذلك في المحطات والشبكات
يأتي انخفاض الأكسجين الذائب فى المياه الخام نتيجة وجود ملوثات تؤدي إلى استهلاك الأكسجين في عمليات الأيض للبكتريا مما يؤدي إلى عدم استمرار الظروف المناسبة لنمو وتكاثر الاسماك وبعض الكائنات المائية الأخرى.
ويتم اجراء اختبارات الأكسجين الذائب للمياه المعالجة بهدف الحد من حدوث تآكل للطلمبات وشبكات المياه وذلك حيث أن زيادة الأكسجين تساعد على تآكل الحديد.
يمكن اعتبار الأكسجين المذاب معيارًا لتحديد نوعية المياه، فالمياه الملوثة بمواد عضوية يقل الأكسجين المذاب بها، ووجود كمية مناسبة من الأكسجين في الماء تعمل على تنقية المياه ذاتيًا.
ب- الأس (الرقم) الأيدروجيني pH
هو تعبير عن شدة قاعدية أو حمضية المياه ويرمز له بالرمز pH وبالتعريف الحسابي هي سالب لوغاريتم تركيز أيون الهيدورجين , ومعظم المياه تتراوح قيمتها ما بين (٦- ٩) وتكون المياه حمضية إذا كانت ايونات الهيدروجين (H+) أكثر من أيونات الهيدروكسيد (OH¯) وقلوية إذا حدث العكس ومتعادلا اذا تساوت القيمتان . وتوجد علاقة أساسية مابين الرقم الهيدروجينى والحموضة والقلوية. والماء الحمضي هو الذي يسبب تآكلا في المعدات أما الماء القلوي فيرسب قشورًا.
أسباب التغير في الرقم الهيدروجيني للمياه وتأثير ذلك على المعالجة:
– وجود الملوثات الزراعية وبعض المخلفات الصناعية في المياه مثل الأملاح غير العضوية والأحماض والقواعد والمواد العضوية والمواد العالقة والمواد المسببة للرغوة… ألخ تغير من الرقم الهيدروجينى للمياه.
– تعتمد معظم العمليات التي تتم بالمحطات على الرقم الهيدروجيني المناسب بالإضافة إلى أن عمليات المتابعة في مراحل المعالجة يمكن أن تساعد في معرفة أي مشاكل موجودة في كل مرحلة، كما يلعب الرقم الهيدروجيني دور كبيرًا في حسابات معامل التشبع للمياه LSI.
ج-عسر المياه Hardness
هو عدم قدرة الماء على تكوين رغوة مع الصابون وتوجد الأملاح المسببة لعسر المياه بتركيزات متفاوتة تزيد عادة في المياه الجوفية حسب مكونات طبقات التربة التي تمر خلالها المياه وأنواعها تنقسم إلى:
1- عسر مؤقت: بسبب أملاح البيكربونات (الكالسيوم/ الماغنسيوم) والتي تذيبها المياه المحتوية على ثاني أكسيد الكربون.
2- عسر دائم: بسبب أملاح كبريتات وكلوريدات الكالسيوم أو كبريتات وكلوريدات الماغنسيوم والتي تذوب بصورة طبيعية في المياه طالما وجدت هذه الاملاح في التربة التي تمر بها المياه.
وفى حين يمكن التخلص من العسر المؤقت بتسخين المياه لتحويل بيكربونات الكالسيوم والماغنسيوم الذائبة إلى كربونات الكالسيوم والماغنسيوم غير الذائبة فإنه يصعب التخلص من العسر الدائم حيث لا يؤثر التسخين على كلوريدات وكبريتات الكالسيوم والماغنسيوم ويمكن التخلص من العسر الدائم بوسائل وتقنيات أخرى مثل التبخير ثم التكثيف والتناضح العكسى والمبادلات الأيونية.
توجد الأملاح المسببة لعسر المياه بتركيزات متفاوتة تزيد عادة في المياه الجوفية حسب مكونات طبقات التربة التي تمر خلالها المياه ويسمح بتركيز مقداره 0.4 مجم مكافئ لكل كيلوجرام من العسر للاستخدام الصناعي فى الغلايات، وأعلى مستوى يسمح به من العسر الكلي هو ١٠٠ مجم/ لتر، بحد أقصى ٥٠٠ مجم/لتر من كربونات الكالسيوم.
تأثير العسر في عمليات التنقية
يسبب العسر المؤقت تكوين طبقات من القشور داخل مواسير المياه والعدادات وأجهزة التسخين كما أنه يكسب الماء طعما غير مستساغ , بالإضافة إلى ان المياه العسرة تسبب مشاكل في التنقية، ولا يمكن التخلص منها في المراحل الأولية بالطرق التقليدية المتبعة.
ح- العكارة Turbidity
العكارة هو تعبير مبسط لعتامة المياه الطبيعية Cloudiness”” وهي مدلول عن وجود بعض المواد العالقة في الماء , وتعتمد طريقة قياس العكارة على مقارنة كمية الضوء الذي يتشتت عند سقوطه على محلول معلق قياسى(فورمازين) بكمية الضوء المشتت عند استخدام العينة وكلما زادت العكارة ازداد التشتت , وتقدر بوحدات .(Nephelometric Turbidity Units) (NTU)
يجب قياس عكارة المياه الخام مرة يوميًا علي الأقل (إلا إذا زادت عكارة المياه الخام عن 20 NTU في هذه الحالة يجي أخذ عينات كل ساعتين). يتم قياس العكارة لكل العينات اليومية الخاصة بالتحليل البكتيريولوجي.
ومصدرها مواد عضوية مثل الطحالب ومواد غير عضوية مثل الطمى والرمال وتكون العكارة فى المياه السطحية أكثر منها فى المياه الجوفية نظرا لأن الأخيرة تتعرض للترشيح خلال مرورها فى طبقات التربة المختلفة.
وتعتبر العكارة من الدلائل الواضحة في إمدادات المياه لأنها تعطي مقياسًا للمخاطر الصحية وتعتبر دليلا علي كفاءة عملية التنقية.
وحديثًا ترتبط الكفاءة العالية لإزالة العكارة بإزالة الكائنات الدقيقة وتشمل الجيارديا Giardia والكريبتوسبوريديم Cryptosporidium.
يتم التخلص من العكارة بالترسيب الطبيعي أو بالترسيب بمساعدة المروبات في أحواض الترويق ثم المرشحات.

تأثير العكارة على مراحل التنقية
للعكارة تاثير علي مراحل تنقية المياه يتمثل في :
- إنسداد المرشحات أثناء عملية التنقية وتكرار عمليات الغسيل.
- زيادة تكون الروبة والرواسب في المروقات وخزانات المياه.
- إنخفاض كفاءة المعالجة وارتفاع درجة تعكر المياه للمراحل المختلفة.
- زيادة إستهلاك الكيماويات مثل المطهرات.
التأثير على الصحة العامة:
طالما توجد جسيمات تعكر المياه فإنها تكون مخابئ تلجأ إليها الكائنات الحية للهروب من تأثير الكلور عليها فلا يتم التطهير الكامل وتصل هذه الكائنات للمستهلك وتصيبه بالأمراض، لذا حددت المواصفات القياسية ان أقصى مستويات للعكارة في مياه الشرب تكون وحدة واحدة N.T.U.
د- القلوية Alkalinity
هي مقدرة المياه على معادلة الأحماض المضافة إليها أو هي مقياس لمدى قدرة الأيونات السالبة الموجودة بالمياه على معادلة الأيونات الموجبة المضافة.
أسباب ارتفاع وانخفاض القلوية
إذا مرت المياه السطحية أو الجوفية على صخور جيرية فإنها تصبح عالية القلوية وكذلك تتأثر القلوية بالملوثات ارتفاعًا أو انخفاضًا حسب نوعية الملوثات الصناعية إذا كانت ذات طبيعة حمضية أو قاعدية. وتحسب قلوية المياه بإضافة حمض الكبريتيك فى وجود دليلي الفينولفثالين والميثيل البرتقالي.
تعزى قلوية المياه لوجود هيدروكسيدات – كربونات – بيكربونات بعض عناصر الأقلاء، ويؤدى ارتفاع قلوية المياه إلى تزايد التكاثر البيولوجي.
وليست هناك أضرار صحية على شرب المياه المحتوية على قلوية حتى ٤٠٠ مجم/ لتر.
أسباب ارتفاع وانخفاض القلوية:
إذا مرت المياه السطحية أو الجوفية على صخور جيرية فإنها تصبح عالية القلوية وكذلك تتأثر القلوية ببعض الملوثات ارتفاعًا أو انخفاضًا حسب نوعية الملوثات الصناعية إذا كانت ذات طبيعة حمضية أو قاعدية.
اهمية القلوية لعمليات المعالجة
تتم عملية الترويب أسرع مع القلوية الأعلى فتؤثر درجة قلوية المياه تأثيرًا مباشرًا في كفاءة الترويب وجرعة المادة المروبه. فعلي سبيل المثال الشبَّه وهي أكثر مواد الترويب استعمالا في تنقية المياه بالترويب تتفاعل مع القلوية (المركبات المسببة للقلوية في الماء) الموجودة في الماء طبيعيًا والقلوية المضافة(إذ يجب توفير مستوى معين من القلوية لحدوث التفاعل) مكونة جسيمات ندفية جيلاتينية هلامية القوام أيدر وكسيد الألومنيوم، لها خاصية تجميع المواد العالقة.
ر- درجة الحرارة
تقاس درجة الحرارة بدرجة السيليزيوس (مئوية) أو الفهرنهيت ويمكن استخدام الترمومتر الزئبقى فى القياس ويجب أن يكون تدريجه يسمح بقراءة 0.1 °م كما يمكن استخدام مجس الحرارة الموجود فى أجهزة قياس الأس الأيدروجينى لهذا الغرض. وتسجل النتيجة الرقمية أو قراءة الترمومتر. وتعتبر درجة الحرارة هامة فى بعض القياسات مثل قياس الرقم الأيدروجينى أو التوصيل الكهربى الذى تتأثر قيمتهما بتغير درجة الحرارة ويجب تسجيل درجة الحرارة التى تم عندها القياس.
دلالة الاختبار
يعتبر اختبار درجة الحرارة من الاختبارات المهمة، حيث يؤدي ارتفاع درجة الحرارة إلى التأثير على التفاعلات الكيميائية، وسرعتها وصلاحية المياه للاستخدام، كما تؤثر على الحياة المائية، لأن ارتفاع درجة الحرارة يقلل من الأكسجين المذاب ولمعرفة مدى تأثير التغير في درجة حرارة المياه على المعالجة نلاحظ الآتي:
الزيادة في درجة حرارة المياه يزيد من سرعة تفاعل المواد الكيماوية المروبة مع العوالق والمواد الموجودة بالمياه وانخفاضها يقلل من سرعة التفاعل، لذلك نجد أن هناك زيادة في استهلاك المواد الكيميائية في وقت الشتاء ويقل في وقت الصيف وربما يصل الأمر إلى الزيادة في الليل عنه في
النهار.
أما بالنسبة للكلور فإن الاستهلاك يزيد في الصيف ويقل في وقت الشتاء لزيادة الملوثات العضوية وكذلك نتيجة لعمليات البخر.
تأثير درجات الحرارة علي كفاءة العمليات
تؤثر درجات الحرارة علي كفاءة العمليات في وحدات محطة التنقية، ويعتمد معدل ذوبان الكيماويات وتفاعلها علي درجة الحرارة. وتحتاج المياه الباردة عمومًا إلي جرعات أكبر من الشبة ليتم الترويق بكفاءة، بينما تحتاج المياه ذات درجات الحرارة المرتفعة إلي جرعات أعلي من الكلور بسبب النشاط الزائد للكائنات الحية والطحالب في المياه الخام ويتم قياس وتسجيل درجة حرارة المياه مرة يوميًا علي الأقل.
أحــمــد السـروي
إستشاري معالجة المياه وجودة المختبرات والبيئة
المراجع العلمية
- احمد السروي ,العمليات الاساسية لتنقية مياه الشرب , دار الكتب العلمية , 2012.
- احمد السيد خليل ,عملية تنقية الماء للاستخدام المنزلي , 2008.
- البرنامج التدريبي لمشغلي محطات تنقية مياه الشرب المستوى (ج) دليل المتدرب ,الجزء الثاني الاختبارات المعملية , مشروع دعم قطاع مياه الشرب والصرف الصحي , الوآالة الأمريكية للتنمية الدولية , 2012.
- البرنامج التدريبي لمحللي معامل تحاليل مياه الشرب المستوى (ج) دليل المتدرب ,الجزء الثاني الاختبارات المعملية , مشروع دعم قطاع مياه الشرب والصرف الصحي , الوآالة الأمريكية للتنمية الدولية , 2013.




